 La cantidad de calor (Q) se define como la energía cedida o absorbida por un cuerpo de masa (m), cuando su temperatura varía en un número determinado de grados algo que se tiene que tener muy en cuenta es que los cuerpos no tienen calor, sino energía interna. El calor es parte de dicha energía interna (energía calorífica) transferida de un sistema a otro, lo que sucede con la condición de que estén a diferente temperatura. La energía existe en varias formas. En este caso nos enfocamos en la cantidad de calor (Q).
La cantidad de calor (Q) se define como la energía cedida o absorbida por un cuerpo de masa (m), cuando su temperatura varía en un número determinado de grados algo que se tiene que tener muy en cuenta es que los cuerpos no tienen calor, sino energía interna. El calor es parte de dicha energía interna (energía calorífica) transferida de un sistema a otro, lo que sucede con la condición de que estén a diferente temperatura. La energía existe en varias formas. En este caso nos enfocamos en la cantidad de calor (Q). La cantidad de calor (Q) está relacionada directamente con la naturaleza de la sustancia que compone el cuerpo. La dependencia de la cantidad de calor con la naturaleza de la sustancia se caracteriza por una magnitud denominada calor específico de la sustancia.
La cantidad de calor (Q) está relacionada directamente con la naturaleza de la sustancia que compone el cuerpo. La dependencia de la cantidad de calor con la naturaleza de la sustancia se caracteriza por una magnitud denominada calor específico de la sustancia. 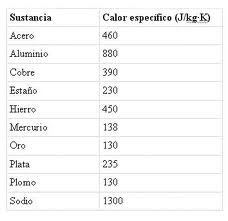 El calor específico de la sustancia se representa con la letra C y se define como la cantidad de calor requerida por la unidad de masa de una sustancia para variar su temperatura en
El calor específico de la sustancia se representa con la letra C y se define como la cantidad de calor requerida por la unidad de masa de una sustancia para variar su temperatura en La fórmula que permite determinar la cantidad de calor (Q) cedida o absorbida por un cuerpo de masa (m) y calor específico (C), cuando su temperatura inicial (ti) varía hasta la temperatura final (tf,), se puede calcular mediante la fórmula: Q = C m (tf - ti).
Un cuerpo de masa (m) puede variar su temperatura inicial mediante un fenómeno térmico si absorbe o cede cierta cantidad de calor (Q). Al considerar que la energía no puede ser creada ni destruida de acuerdo con la ley de conservación de la energía, entonces la energía absorbida o cedida por un cuerpo debe, en principio, ser cedida o absorbida por otro cuerpo.
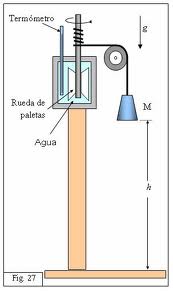
Podemos observar que si se agita un recipiente con agua, se puede comprobar con un termómetro muy sensible, que se produce un aumento de temperatura. Este cambio se interpreta como un aumento de la energía Cinética de las moléculas a causa de su mayor agitación. Se ha hecho un trabajo sobre el sistema que incide en el aumento de energía interna haciendo que las moléculas se muevan con mayor rapidez, lo cual se traduce en una mayor temperatura del sistema.
La temperatura es una magnitud proporcional a la energía media de las moléculas, es entonces, independiente del número de ellas y por ende de la masa del sistema. La cantidad de calor depende de las energías de todas las moléculas, se debe por consiguiente, a la masa del sistema.
Una unidad de calor muy usada es la Caloría. Es la cantidad de calor necesario para elevar la temperatura de un gramo de agua desde 14.5 grados centígrados hasta 15.5 grados centígrados. Se especifica este intervalo porque la cantidad de calor necesario para elevar la temperatura en 1 grado centígrado depende, precisamente, de esta.
Se necesita diferente cantidad de calor para llevar un gramo de agua desde 10 grados centígrados, hasta 11 grados centígrados que desde 50 grados centígrados hasta 51 grados centígrados. Las sustancias difieren, unas de otras, en la cantidad de calor que necesitan para elevar, la unidad de masa, en un mismo intervalo de temperatura.
